Q and Aのご利用にあたってのご注意
Q and Aは、医療従事者からのよくある質問とその回答をまとめた情報提供サイトです。
本サイトに記載されている情報は、製品の適正使用にあたって参考となる情報の提供を目的としているものです。 第三者への公開(学会発表、書籍や雑誌への投稿、Webサイトへの掲載等)はお控えください。
本回答は全てのケースに当てはまるものではありません。そのため、参考情報としてご利用いただき、回答の内容を利用して生じた結果については、 責任を負いかねますので、ご了承ください。
製品のご使用にあたっては、最新の電子添文をご確認ください。
その他、ご不明な点がございましたら、弊社担当MRまでお問い合わせください。
Q and Aのご利用にあたり、上記の注意事項をお守りください。
同意する
Q and A
特徴・DI
パルモディアの特徴について教えてください。
用法・用量について教えてください。
有効性
スタチン併用時の効果について教えてください。
長期投与による効果の減弱はありますか?
パルモディアは家族性高脂血症への投与例はありますか?
安全性
スタチンとの併用について教えてください。
脂質異常症治療薬を処方する際に注意すべき臨床検査値について教えてください。
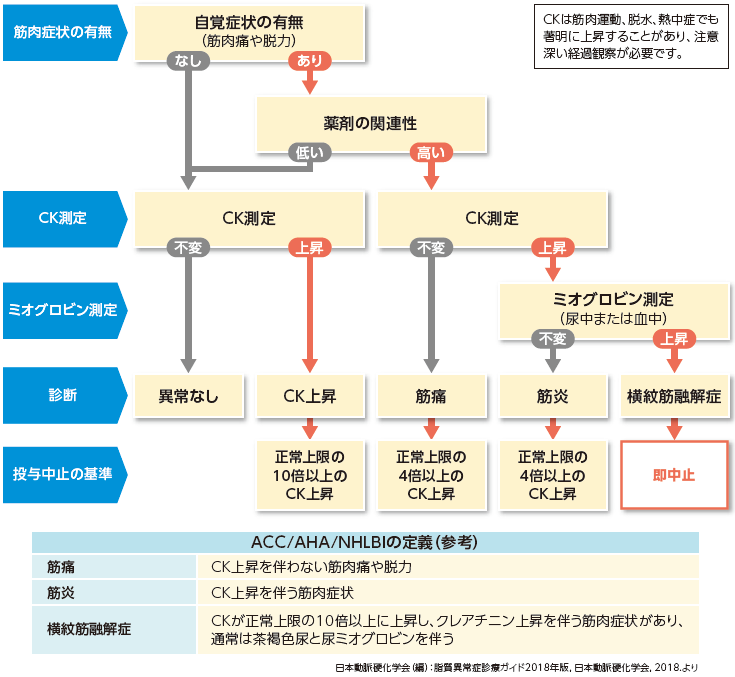
横紋筋融解症の診断について教えてください。
横紋筋融解症の症状と対処法について教えてください。
CKへの影響について教えてください。
妊婦・産婦・授乳婦への投与について教えてください。
n-3系多価不飽和脂肪酸との併用は可能ですか?
薬物動態・薬物相互作用
食事の影響は受けますか?
薬物相互作用について教えてください。
スタチンとの薬物相互作用について教えてください。
薬物動態について教えてください。
その他
飲み忘れた時の対処について教えてください。
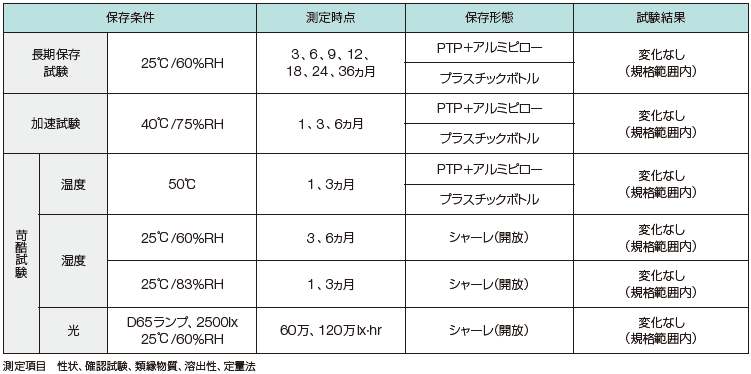
一包化時の安定性について教えてください。
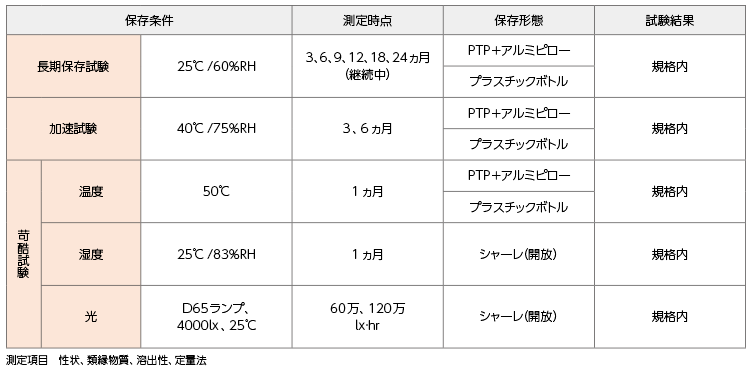
分割時の安定性について教えてください。
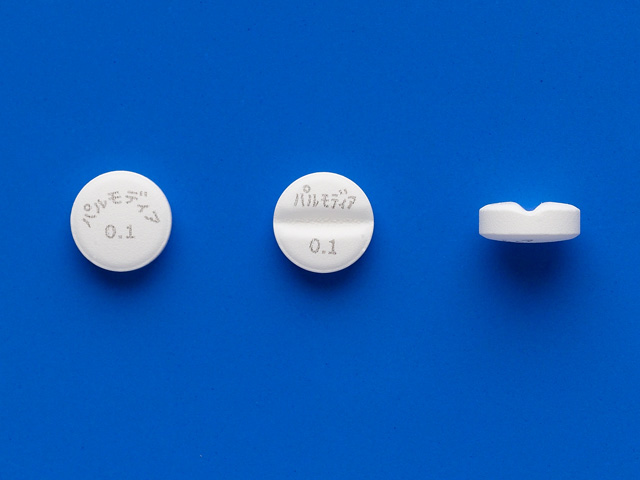
錠剤の大きさについて教えてください。