薬物動態
- パルモディア錠
(即放性製剤) - パルモディアXR錠
(徐放性製剤)
パルモディア錠(即放性製剤)
血漿中濃度
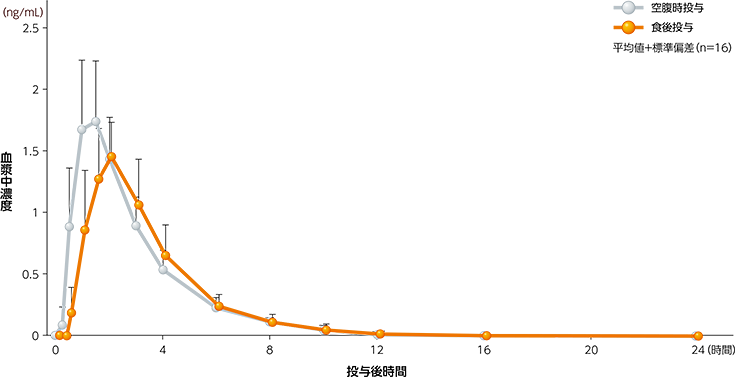
(1)健康成人における単回投与時の血漿中濃度(食事の影響試験)1)
健康成人男性にパルモディア錠(即放性製剤)0.1mgを空腹時及び食後に単回経口投与したときの薬物動態パラメータは次表のとおりであり、空腹時投与では投与後約1.50時間、食後投与では投与後1.75時間に最高値に達し、その後は速やかに消失した。
食事摂取により血漿中濃度の上昇は緩やかとなり最高濃度到達時間の遅延傾向が認められたが、その程度は軽微であった。空腹時投与に対する食後投与のCmax及びAUC0-tの幾何平均値の比[90%信頼区間]は、0.873[0.803, 0.950]及び0.911[0.863, 0.961]であった。
血漿中ペマフィブラート濃度推移(単回経口投与)
薬物動態パラメータ(単回経口投与)
| Cmax(ng/mL) | AUC0-inf(ng・h/mL) | tmax(h) | t1/2(h) | |
|---|---|---|---|---|
| 空腹時投与 | 1.82±0.54 | 5.75±1.50 | 1.50(1.00, 2.00) | 1.88±0.31 |
| 食後投与 | 1.54±0.26 | 5.18±1.20 | 1.75(1.00, 3.00) | 1.73±0.42 |
Cmax、AUC0-inf、t1/2:平均値±標準偏差
tmax:中央値(最小値, 最大値)
n=16
方法:健康成人男性(16例)にパルモディア錠(即放性製剤)0.1mgをクロスオーバー法にて空腹時及び食後に単回経口投与した。
(2)健康成人及び高TG血症患者における反復投与時の血漿中濃度2)
健康成人男性にパルモディア錠(即放性製剤)0.2mg/日及び0.4mg/日を1日2回に分けて7日間反復経口投与したとき、ペマフィブラートの血漿中濃度はDay2以降、ほぼ安定した推移を示しており、Day2には定常状態に到達したものと考えられた。Day1及びDay7のAUC0-τの比から算出した累積係数(RobsAUC、平均値)は1.0997及び1.1169であり、反復投与による蓄積や曝露の減少はないものと判断された。高TG血症患者にパルモディア錠(即放性製剤)0.2mg/日を1日2回に分けて15日間反復経口投与したとき、Day1及びDay15のAUC0-τの比から算出した累積係数(RobsAUC、平均値)は1.1383であり、反復投与による蓄積や曝露の減少はないものと判断された。また、ペマフィブラートの血漿中濃度の推移を高TG血症患者と健康成人男性で比較したところ、高TG血症患者のDay15の推移は、健康成人男性のDay7の推移と同様であった。
血漿中ペマフィブラート濃度推移(反復経口投与、食後投与)
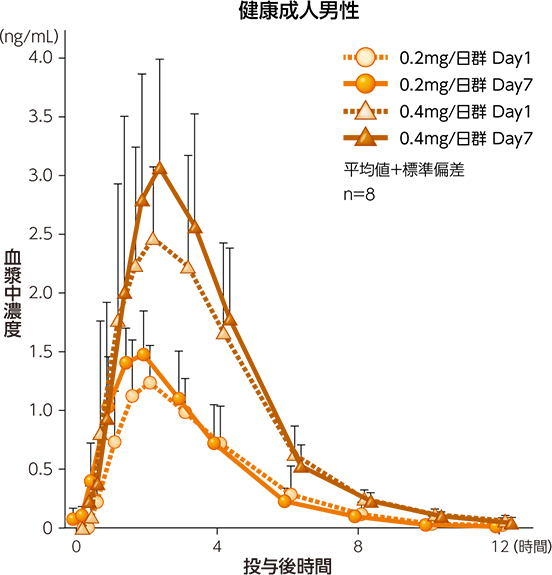
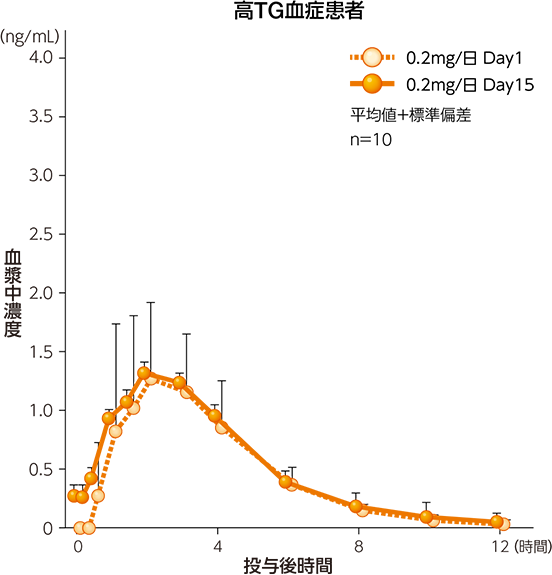
薬物動態パラメータ(反復経口投与、食後投与)
健康成人男性
| 1日投与量 | Cmax (ng/mL) |
AUC0-τ (ng・h/mL) |
tmax (h) |
t1/2 (h) |
|
|---|---|---|---|---|---|
| Day1 | 0.2 mg |
1.401 ±0.249 |
4.884 ±1.201 |
2.000 (1.00, 3.00) |
- |
| 0.4 mg |
2.968 ±0.905 |
10.975 ±2.335 |
2.000 (1.00, 3.00) |
- | |
| Day7 | 0.2 mg |
1.593 ±0.366 |
5.404 ±1.515 |
2.000 (1.00, 3.00) |
1.528 ±0.402 |
| 0.4 mg |
3.572 ±1.021 |
12.207 ±2.900 |
2.000 (1.00, 3.00) |
1.708 ±0.158 |
|
| 累積 係数 |
0.2 mg |
- | 1.0997 ±0.0688 |
- | - |
| 0.4 mg |
- | 1.1169 ±0.1814 |
- | - | |
Cmax、AUC0-τ、t1/2:平均値±標準偏差
tmax:中央値(最小値, 最大値)
n=8
高TG血症患者
| Cmax (ng/mL) |
AUC0-τ (ng・h/mL) |
tmax (h) |
t1/2 (h) |
|
|---|---|---|---|---|
| Day1 | 1.517 ±0.766 |
5.590 ±2.049 |
2.000 (1.00, 4.00) |
- |
| Day15 | 1.478 ±0.664 |
6.301 ±2.280 |
2.000 (1.50, 4.00) |
2.043 ±0.413 |
| 累積 係数 |
- | 1.1383 ±0.2032 |
- | - |
Cmax、AUC0-τ、t1/2:平均値±標準偏差
tmax:中央値(最小値, 最大値)
n=10
方法:健康成人男性(8例)にパルモディア錠(即放性製剤)0.2mg/日及び0.4mg/日を1日2回に分けて朝夕食後7日間反復経口投与した。また、高TG血症患者(10例)にパルモディア錠(即放性製剤)0.2mg/日を1日2回に分けて朝夕食後15日間反復経口投与した。
(3)肝機能障害患者における血漿中濃度
・脂肪肝患者及び肝硬変患者を対象とした薬物動態試験 3)
肝機能正常者、脂肪肝患者及び肝硬変患者(Child-Pugh分類A、Child-Pugh分類B)にパルモディア錠(即放性製剤)0.2mgを単回経口投与したとき、ペマフィブラートの血漿中濃度は、いずれの群も投与後1~1.5時間に最高値に達し、その後速やかに低下した。肝硬変患者群Child-Pugh分類Bでは、消失が遅い傾向がみられた。Cmax及びAUC0-t(幾何平均値)は、肝硬変の程度に応じた増加が認められた。
肝機能正常者群及び脂肪肝患者群でのCmax及びAUC0-tの幾何平均値に関して、肝機能正常者群に対する脂肪肝患者群の比は、それぞれ1.198倍及び1.194倍であり、脂肪肝患者群で曝露がわずかに高い傾向がみられた。
肝機能正常者、脂肪肝患者及び肝硬変患者におけるパルモディア錠(即放性製剤)投与時のペマフィブラートの薬物動態パラメータ
| Cmax(ng/mL) | AUC0-t(ng・h/mL) | tmax(h) | t1/2(h) | ||
|---|---|---|---|---|---|
| 肝機能正常者群、n=8 | 2.833(38.6) | 8.750(29.5) | 1.500(1.00, 1.50) | 1.610(18.7) | |
| 脂肪肝患者群、n=10 | 3.393(51.9) | 10.451(47.8) | 1.500(1.00, 2.00) | 1.884(44.9) | |
| 幾何平均値の比a) [90%信頼区間] |
1.198 [0.819, 1.750] |
1.194 [0.836, 1.707] |
- | - | |
| 軽度の肝硬変患者群 Child-Pugh分類A、n=8 |
6.599(24.1) | 18.169(34.5) | 1.000(1.00, 1.50) | 2.006(17.2)b) | |
| 幾何平均値の比a) [90%信頼区間] |
2.329 [1.561, 3.475] |
2.076 [1.425, 3.026] |
- | - | |
| 中等度の肝硬変患者群 Child-Pugh分類B、n=6 |
10.998(31.6) | 36.672(45.7) | 1.000(1.00, 1.50) | 3.237(47.5) | |
| 幾何平均値の比a) [90%信頼区間] |
3.882 [2.520, 5.980] |
4.191 [2.790, 6.294] |
- | - | |
Cmax、AUC0-t、t1/2:幾何平均値(変動係数(%))、tmax:中央値(最小値, 最大値)
a)肝機能正常者群に対する各肝機能障害患者群の比、b)n=7
方法:成人男性の肝機能正常者(8例)、脂肪肝患者(10例)及び肝硬変患者(Child-Pugh分類A:8例、Child-Pugh分類B:8例)にパルモディア錠(即放性製剤)0.2mgを単回経口投与した。
(4)腎機能障害患者における血漿中濃度
・腎機能障害患者を対象とした薬物動態試験 4)
腎機能正常者及び腎機能障害患者(軽度、中等度、高度、末期腎不全)にパルモディア錠(即放性製剤)0.2mgを単回経口投与したとき、Cmax及びAUC0-t(幾何平均値)は、腎機能正常者群と比較し腎機能障害患者群で1.1~1.6倍の増加がみられたが、腎機能障害の程度に依存した増加は認められなかった。ペマフィブラートの主な排泄経路は胆汁中であり、腎機能の程度は、ペマフィブラートの薬物動態に影響を及ぼさなかった。
腎機能正常者及び腎機能障害患者(軽度、中等度、高度、末期腎不全)におけるパルモディア錠(即放性製剤)投与時のペマフィブラートの薬物動態パラメータ
| Cmax(ng/mL) | AUC0-t(ng・h/mL) | tmax(h) | t1/2(h) | ||
|---|---|---|---|---|---|
| 腎機能正常者群、n=8 | 2.900(23.9) | 9.293(29.1) | 1.500(1.00, 2.00) | 2.229(40.7) | |
| 軽度腎機能障害患者群、n=8 | 4.769(30.7) | 15.143(32.1) | 1.250(1.00, 2.00) | 2.835(17.3)b) | |
| 幾何平均値の比a) [90%信頼区間] |
1.644 [1.155, 2.342] |
1.629 [1.161, 2.287] |
- | - | |
| 中等度腎機能障害患者群、n=8 | 3.169(46.2) | 10.728(49.6) | 1.500(0.50, 4.00) | 2.369(36.8) | |
| 幾何平均値の比a) [90%信頼区間] |
1.093 [0.767, 1.556] |
1.154 [0.822, 1.620] |
- | - | |
| 高度腎機能障害患者群、n=7 | 4.482(71.7) | 12.046(63.8) | 1.000(0.50, 4.00) | 2.679(53.3)c) | |
| 幾何平均値の比a) [90%信頼区間] |
1.545 [1.072, 2.228] |
1.296 [0.913, 1.841] |
- | - | |
| 末期腎不全者群、n=7 | 3.648(41.6) | 14.931(45.2) | 1.500(1.00, 2.00) | 2.864(28.2) | |
| 幾何平均値の比a) [90%信頼区間] |
1.258 [0.872, 1.813] |
1.607 [1.131, 2.282] |
- | - | |
Cmax、AUC0-t、t1/2:幾何平均値(変動係数(%))、tmax:中央値(最小値, 最大値)
a)腎機能正常者群に対する各腎機能障害患者群の比、b)n=7、c)n=6
方法:成人男性の腎機能正常者(80mL/min≤Ccr、8例)、腎機能障害患者[軽度(50≤Ccr<80mL/min、8例)、中等度(30≤Ccr<50mL/min、9例)、高度(Ccr<30mL/min、8例)及び末期腎不全(血液透析で治療中、8例)]にパルモディア錠(即放性製剤)0.2mgを単回経口投与した。
2. 禁忌(次の患者には投与しないこと)(抜粋)
2.2 重篤な肝障害、Child-Pugh分類B又はCの肝硬変のある患者あるいは胆道閉塞のある患者[8.3、9.3.1、16.6.2 参照]
7. 用法及び用量に関連する注意
急激な腎機能の悪化を伴う横紋筋融解症があらわれることがあるので、投与にあたっては患者の腎機能を検査し、eGFRが30mL/min/1.73m2未満の場合は、低用量から投与を開始、減量又は投与間隔の延長を行うこと。また、最大用量は1日0.2mgまでとする。[9.2.1、9.2.2、11.1.1、16.6.1 参照]
8. 重要な基本的注意(抜粋)
8.3 本剤は肝機能及び肝機能検査値に影響を及ぼすことがあるので、投与中は定期的に肝機能検査を行うこと。[2.2、9.3.1、9.3.2、11.2.2 参照]
9. 特定の背景を有する患者に関する注意(抜粋)
9.2 腎機能障害患者
9.2.1 eGFRが30mL/min/1.73m2未満の腎機能障害のある患者
横紋筋融解症があらわれることがある。[7.、11.1.1、16.6.1 参照]
9.3 肝機能障害患者
9.3.1 重篤な肝障害、Child-Pugh分類B又はCの肝硬変のある患者あるいは胆道閉塞のある患者
投与しないこと。肝障害を悪化させるおそれがある。また、本剤の血漿中濃度が上昇するおそれがある。[2.2、8.3、16.6.2 参照]
9.3.2 肝障害のある患者(Child-Pugh分類Aの肝硬変のある患者等)又は肝障害の既往歴のある患者(9.3.1に該当する患者を除く)
必要に応じて本剤の減量を考慮すること。また、本剤の増量の必要性を慎重に判断すること。肝機能検査値の異常変動があらわれるおそれがある。また、肝障害のある患者(Child-Pugh分類Aの肝硬変のある患者等)では本剤の血漿中濃度が上昇するおそれがある。[8.3、16.6.2 参照]
11. 副作用(抜粋)
11.1 重大な副作用
11.1.1 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症があらわれ、これに伴って急性腎不全等の重篤な腎障害があらわれることがあるので、このような場合には直ちに投与を中止し、適切な処置を行うこと。[7.、9.2.1、9.2.2、10.2 参照]
11.1.2 肝機能障害、黄疸(いずれも頻度不明)[8.3 参照]
11.2 その他の副作用 肝機能異常、AST上昇、ALT上昇
排泄
(1)尿中及び糞中排泄率(外国人データ)6)
健康成人男性(7例)に14C-ペマフィブラート0.8mgを単回経口投与したとき、総放射能回収率(平均値)は投与量の87.81%であり、尿中へ14.53%、糞中へ73.29%の放射能が排泄された。尿中への排泄は投与24時間後までにほぼ終了したが、糞中への排泄は投与96時間後までにほぼ終了した。
尿中に認められたペマフィブラートは、投与放射能の0.47%以下であった。投与放射能の5%を超える成分が1種類認められ、ジカルボン酸体のグルクロン酸抱合体及びN-脱アルキル体の混合物と同定された。
糞中に認められたペマフィブラートは、投与放射能の1.69%以下であった。糞中代謝物の大部分(投与放射能の約50%)を占める成分は4-メトキシフェニル基脱メチル体と同定された。その他、投与放射能の5%を超える成分が2種類認められ、それぞれベンゾオキサゾール基(6位)水酸化体及びその4-メトキシフェニル基脱メチル体と同定された。
(2)呼気中排泄(ラット)7)
絶食の雌雄ラットに14C-ペマフィブラート1mg/kgを単回静脈内投与したとき、雌雄共に呼気中に放射能は検出されなかった。
(3)胆汁中排泄及び腸肝循環(ラット)7)
絶食の雄ラットに14C-ペマフィブラート1mg/kgを単回経口投与したとき、投与放射能の69.5%が、投与後48時間までに胆汁中に排泄された。
また、投与後8時間まで採取した胆汁を2g/kgの投与量で別個体の絶食の雄ラットに単回十二指腸内投与したとき、投与した胆汁中放射能の60.0%が、投与後48時間までに胆汁中に排泄された。
(4)トランスポーターを介した輸送(in vitro)7)
14C-ペマフィブラートは、in vitroにおいて、P-gp 、BCRP、OATP1A2、OATP1B1、OATP1B3、OCT2及びNTCPで輸送されることが示された。
【パルモディア錠(即放性製剤)0.1mg】
通常、成人にはペマフィブラートとして1回0.1mgを1日2回朝夕に経口投与する。なお、年齢、症状に応じて適宜増減するが、最大用量は1回0.2mgを1日2回までとする。
薬物相互作用
(1)薬物代謝酵素及びトランスポーターに対する作用(in vitro)7)
ペマフィブラートはCYP2C9及びUGT1A1の代謝活性を阻害したが(IC50:17.7μmol/L及び5.91μmol/L)、臨床最大用量におけるヒト血漿中Cmax(0.00772μmol/L)に比べIC50は明らかに高値であった。CYP1A2、CYP2A6、CYP2B6、CYP2C8、CYP2C19、CYP2D6、CYP2E1、CYP3A4/5及びUGT2B7に対する阻害作用はほとんど認められなかった(IC50>30μmol/L)。CYP1A2、CYP2B6及びCYP3A4に対する誘導作用はほとんど示されなかった。
また、P-gp、BCRP、OATP1B1、OATP1B3、OAT1、OAT3及びMRP4を阻害したが(IC50:20.8、4.42、0.101、1.84、2.42、0.0961及び2~20μmol/L)、臨床最大用量におけるヒト血漿中Cmaxと比べると、各IC50は明らかに高値であった。また、理論消化管濃度(1.63μmol/L)と比べると、P-gp及びBCRPのIC50は高値であった。OCT2、MATE1、MATE2-K、OCT1、MRP2及びBSEPに対する阻害作用はほとんど認められなかった(OCT2:IC50>12.5μmol/L、その他:IC50>20μmol/L)。
(2)陰イオン交換樹脂の影響(in vitro)7)
ペマフィブラートの各種陰イオン交換樹脂(コレスチラミン、コレスチミド錠(日局)及びコレスチミド顆粒(日局))に対する吸着率を絶食時の人工腸液及び非絶食時の人工腸液中で評価した結果は次表のとおりであり、ペマフィブラートは食事の有無によらず陰イオン交換樹脂に吸着されやすいものと推察された。
ペマフィブラートの陰イオン交換樹脂への吸着率
| 陰イオン交換樹脂 | ペマフィブラート(0.8μg/mL)の 陰イオン交換樹脂への吸着率a)(%) |
||
|---|---|---|---|
| 名称 | 濃度 | 絶食時の人工腸液 | 非絶食時の人工腸液 |
| コレスチラミン | 16,000μg/mL | 100±0 | 97.0±0.1 |
| コレスチミド錠(日局) | 8,000μg/mL | 90.7±0.3 | 98.3±0.1 |
| コレスチミド顆粒(日局) | 8,000μg/mL | 90.8±0.1 | 98.0±0.2 |
平均値±標準偏差(n=3)
インキュベーション時間:120分
a) ペマフィブラートの陰イオン交換樹脂への吸着率(%)=(1-吸着陰イオン交換樹脂ありの場合のペマフィブラートの濃度/陰イオン交換樹脂なしの場合のペマフィブラートの平均濃度)×100
10.2 併用注意(併用に注意すること)
陰イオン交換樹脂(コレスチラミン、コレスチミド)
(3)シクロスポリン、リファンピシン、クロピドグレル、クラリスロマイシン、フルコナゾール、ジゴキシン、ワルファリンとの併用(外国人データ)8)
健康成人(外国人)に本剤と各種薬剤を併用投与したとき、薬物動態パラメータ等への影響は次表のとおりであった。
パルモディア錠(即放性製剤)と各薬剤を併用投与したときの薬物動態パラメータ等への影響
| 併用薬 | 併用薬投与量 | 本剤投与量 | 測定対象 | 幾何平均値の比[90%信頼区間] (併用投与時/単独投与時) |
|
|---|---|---|---|---|---|
| Cmax | AUC0-inf | ||||
| シクロスポリン | 600mg単回 | 0.4mg単回 | 本剤 | 8.9644 [7.5151, 10.6931] n=14 |
13.9947 [12.6175, 15.5223] n=12 |
| リファンピシン | 600mg単回 | 0.4mg単回 | 本剤 | 9.4336 [8.3626, 10.6419] n=20 |
10.9009 [9.9154, 11.9844] n=17 |
| 600mg/日 1日1回10日間 単独投与 |
0.4mg単回 単独投与 |
本剤 | 0.3792a) [0.3378, 0.4257] n=20 |
0.2221a) [0.2065, 0.2389] n=16 |
|
| クロピドグレル | 300mg単回 4日目 |
0.4mg単回 4日目 |
本剤 | 1.4855 [1.3915, 1.5858] n=20 |
2.3728 [2.2473, 2.5052] n=20 |
| 75mg/日 1日1回5日間 5~9日目 |
0.4mg単回 7日目 |
本剤 | 1.3415 [1.2583, 1.4302] n=20 |
2.0876 [1.9811, 2.1998] n=20 |
|
| クラリスロ マイシン |
1,000mg/日 1日2回8日間 |
0.4mg単回 | 本剤 | 2.4246 [2.1632, 2.7174] n=18 |
2.0975 [1.9158, 2.2964] n=17 |
| フルコナゾール | 400mg/日 1日1回11日間 |
0.4mg単回 | 本剤 | 1.4409 [1.2899, 1.6096] n=19 |
1.7891 [1.6638, 1.9239] n=17 |
| ジゴキシン | 0.5mg/日 1日2回(1日目)、 0.25mg/日 1日1回16日間 |
0.8mg/日 1日2回 6日間 11~16日目 |
ジゴキシン | 1.0325 [0.9511, 1.1210] n=19 |
0.9463b) [0.9090, 0.9850] n=19 |
| ワルファリン※ | 5mg/日 1日1回(1、2日目)、 維持用量c) 1日1回21日間 |
0.4mg/日 1日2回 8日間 14~21日目 |
R-ワルファリン | 1.004 [0.972, 1.037] n=19 |
1.029b) [1.004, 1.055] n=19 |
| S-ワルファリン | 0.929 [0.889, 0.970] n=19 |
0.951b) [0.926, 0.976] n=19 |
|||
a) リファンピシン反復投与前の本剤単独投与時に対するリファンピシン反復投与後の本剤単独投与時のCmax及びAUC0-infの幾何平均値の比[90%信頼区間]
b) AUC0-τ
c) 3~9日目はPT-INR(プロトロンビン時間の国際標準比)が1.2~2.2になるよう投与量を調整し、10日目以降はPT-INRが1.2~2.2になる維持用量を投与した。
※ PT-INR及びPTのワルファリン単独反復投与時に対する本剤併用反復投与時の最小二乗平均値の比[90%信頼区間]は、1.0196[0.9878, 1.0514](n=19)及び1.0191[0.9869, 1.0512](n=19)であった。
2. 禁忌(次の患者には投与しないこと)(抜粋)
2.5 シクロスポリン、リファンピシンを投与中の患者[10.1、16.7.1 参照]
10. 相互作用(抜粋)
10.1 併用禁忌(併用しないこと)
シクロスポリン(サンディミュン)(ネオーラル)、リファンピシン(リファジン)[2.5、16.7.1 参照]
(4)HMG-CoA還元酵素阻害薬との併用(外国人データを含む)9)
健康成人男性(外国人を含む)に本剤とHMG-CoA還元酵素阻害薬を併用投与したとき、薬物動態パラメータへの影響は次表のとおりであった。
パルモディア錠(即放性製剤)と各薬剤を併用投与したときの薬物動態パラメータへの影響
| 併用薬 | 併用薬投与量 | 本剤投与量 | 測定対象 | 幾何平均値の比[90%信頼区間] (併用投与時/単独投与時) |
|
|---|---|---|---|---|---|
| Cmax | AUC0-τ | ||||
| アトルバスタチン | 20mg/日 1日1回7日間 |
0.4mg/日 1日2回7日間 |
本剤 (n=18) |
1.166 [1.069, 1.272] |
1.098 [1.016, 1.187] |
| アトルバスタチン (n=18) |
1.032 [0.960, 1.109] |
0.934 [0.851, 1.024] |
|||
| ο-ヒドロキシ アトルバスタチン (n=18) |
0.875 [0.826, 0.927] |
0.784 [0.736, 0.836] |
|||
| シンバスタチン | 20mg/日 1日1回7日間 |
0.4mg/日 1日2回7日間 |
本剤 (n=18) |
1.230 [1.090, 1.388] |
1.125 [0.997, 1.270] |
| シンバスタチン (n=19) |
0.858 [0.660, 1.114] |
0.846 [0.722, 0.992] |
|||
| シンバスタチン オープンアシド体 (n=19) |
0.626 [0.541, 0.725] |
0.405 [0.345, 0.475] |
|||
| ピタバスタチン | 4mg/日 1日1回7日間 |
0.4mg/日 1日2回7日間 |
本剤 (n=18) |
1.061 [0.970, 1.160] |
1.122 [1.041, 1.209] |
| ピタバスタチン (n=18) |
1.011 [0.973, 1.050] |
1.036 [1.007, 1.066] |
|||
| プラバスタチン | 20mg/日 1日1回7日間 |
0.4mg/日 1日2回7日間 |
本剤 (n=18) |
1.058 [0.964, 1.162] |
1.057 [1.013, 1.102] |
| プラバスタチン (n=18) |
1.107 [0.908, 1.351] |
1.065 [0.922, 1.231] |
|||
| フルバスタチン | 60mg/日 1日1回7日間 |
0.4mg/日 1日2回7日間 |
本剤 (n=18) |
1.181 [1.080, 1.290] |
1.207 [1.144, 1.274] |
| フルバスタチン (n=18) |
0.989 [0.790, 1.239] |
1.151 [1.057, 1.253] |
|||
| ロスバスタチン | 20mg/日 1日1回7日間 |
0.4mg/日 1日2回7日間 |
本剤 (外国人、n=24) |
1.106 [1.048, 1.167] |
1.110 [1.046, 1.177] |
| ロスバスタチン (外国人、n=24) |
1.092 [1.016, 1.174] |
1.025 [0.964, 1.091] |
|||
【パルモディア錠(即放性製剤)0.1mg】
通常、成人にはペマフィブラートとして1回0.1mgを1日2回朝夕に経口投与する。なお、年齢、症状に応じて適宜増減するが、最大用量は1回0.2mgを1日2回までとする。
9. 特定の背景を有する患者に関する注意(抜粋)
9.2 腎機能障害患者
9.2.2 腎機能に関する 臨床検査値に異常が認められる患者
本剤とHMG-CoA還元酵素阻害薬を併用する場合には、治療上やむを得ないと判断される場合にのみ併用すること。急激な腎機能悪化を伴う横紋筋融解症があらわれやすい。やむを得ず併用する場合には、本剤を少量から投与開始するとともに、定期的に腎機能検査等を実施し、自覚症状(筋肉痛、脱力感)の発現、CK(CPK)上昇、血中及び尿中ミオグロビン上昇並びに血清クレアチニン上昇等の腎機能の悪化を認めた場合は直ちに投与を中止すること。[7.、10.2、11.1.1 参照]
10. 相互作用
10.2 併用注意(併用に注意すること)
HMG-CoA還元酵素阻害薬(プラバスタチンナトリウム、シンバスタチン、フルバスタチンナトリウム等)[9.2.2、11.1.1 参照]、クロピドグレル硫酸塩、クラリスロマイシン、フルコナゾール[16.7.1 参照]
主要文献
1 ) 興和(株)社内資料:第Ⅲ相食事の影響試験(パルモディア錠0.1mg)
2 ) 興和(株)社内資料:第Ⅰ相反復投与試験(パルモディア錠0.1mg)
3 ) 興和(株)社内資料:第Ⅲ相肝機能障害患者を対象とした薬物動態試験(パルモディア錠0.1mg)
4 ) 興和(株)社内資料:第Ⅲ相腎機能障害患者を対象とした薬物動態試験(パルモディア錠0.1mg)
6 ) 興和(株)社内資料:第Ⅰ相マスバランス試験(海外)(パルモディア錠0.1mg)
7 ) 興和(株)社内資料:非臨床試験 薬物動態試験(パルモディア錠0.1mg)
8 ) 興和(株)社内資料:薬物相互作用試験①(海外)(パルモディア錠0.1mg)
9 ) 興和(株)社内資料:薬物相互作用試験②(海外を含む)(パルモディア錠0.1mg)
パルモディアXR錠(徐放性製剤)
血漿中濃度
(1)反復投与5)
TG高値の脂質異常症患者にXR錠0.4mg/日群を1日1回食前又は食後に4週間反復経口投与したとき、投与4週時の血漿中濃度推移及び薬物動態パラメータは次のとおりであった。
TG高値の脂質異常症患者におけるXR錠0.4mg/日群食前又は食後反復経口投与4週時の血漿中ペマフィブラート濃度推移
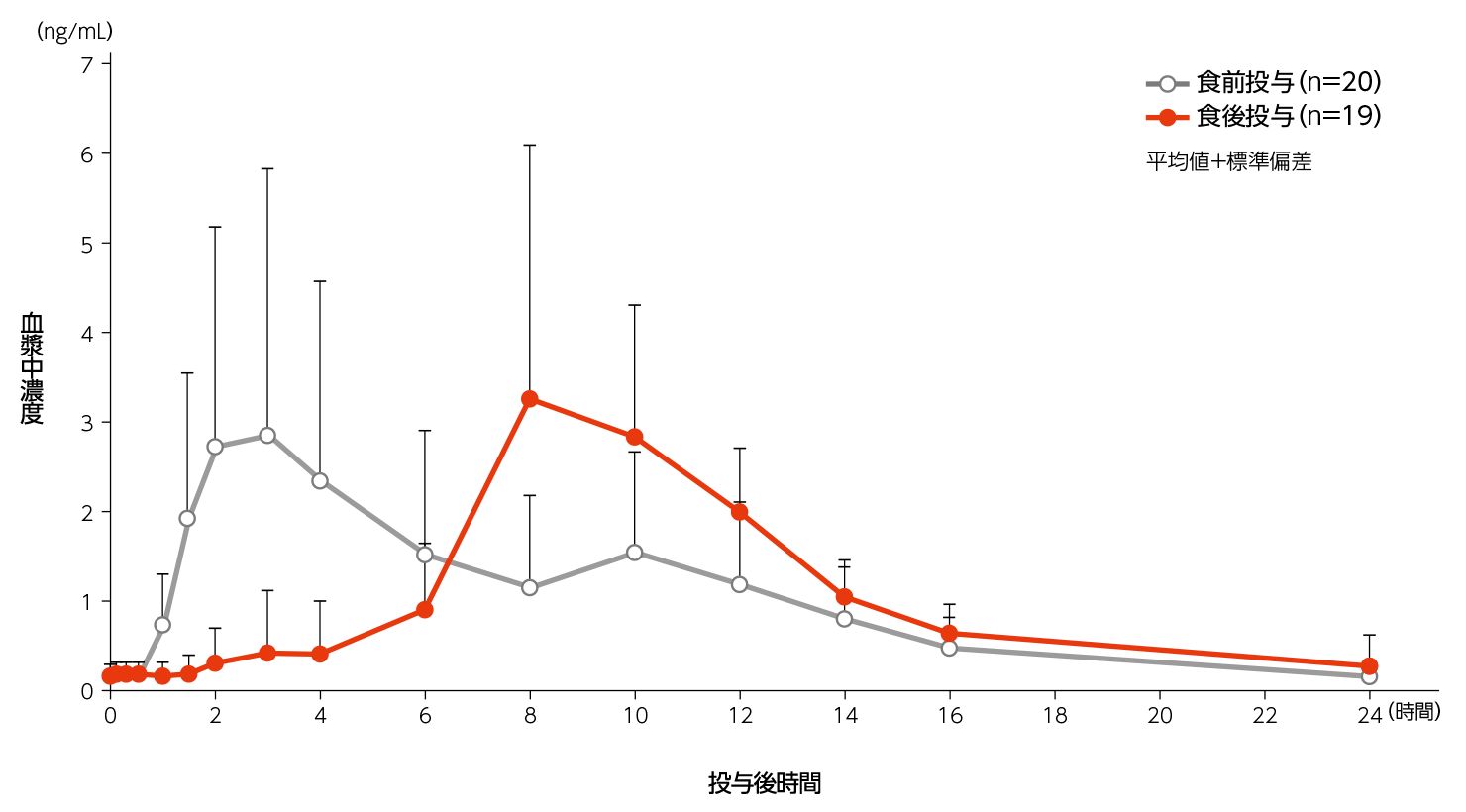
TG高値の脂質異常症患者におけるXR錠0.4mg/日群食前又は食後反復経口投与4週時の薬物動態パラメータ
| Cmax(ng/mL) | AUC0-τ(ng・h/mL) | tmax(h) | t1/2(h) | |
|---|---|---|---|---|
| 食前投与 | 3.1283 (70.6) n=20 |
22.7233 (61.8) n=20 |
3.00 (1.5, 14.0) n=20 |
5.549 (43.6) n=17 |
| 食後投与 | 3.5149 (59.3) n=19 |
24.9334 (37.7) n=19 |
8.00 (3.0, 11.9) n=19 |
4.185 (23.6) n=17 |
Cmax、AUC0-τ、t1/2:幾何平均値(変動係数(%))
tmax:中央値(最小値, 最大値)
XR錠0.4mg/日群投与4週時の食前投与に対する食後投与のCmax及びAUC0-τの幾何平均値の比
| 薬物動態パラメータの幾何平均値の比a)[90%信頼区間] | |
|---|---|
| Cmax | 1.124[0.840, 1.503] |
| AUC0-τ | 1.097[0.879, 1.370] |
a) 食前投与に対する食後投与の比
方法:TG高値の脂質異常症患者にXR錠0.4mg/日群を1日1回食前又は食後に4週間反復経口投与した(2期クロスオーバー)。
(2)徐放性製剤(パルモディアXR錠)と即放性製剤(パルモディア錠)の比較5)
TG高値の脂質異常症患者にXR錠0.4mg/日群を1日1回又はパルモディア錠0.2mg/日を1日2回に分けて食前又は食後に4週間反復経口投与したとき、ペマフィブラートの1日用量を同等に補正したパルモディア錠0.2mg/日投与4週時に対するXR錠0.4mg/日群投与4週時のAUC0-τの幾何平均値の比[90%信頼区間]は、食前投与時と食後投与時でそれぞれ0.863[0.797, 0.934]、0.870[0.788, 0.960]であった。
即放性製剤に対する本剤の薬物動態パラメータの幾何平均値の比
| 薬物動態パラメータの幾何平均値の比a)[90%信頼区間] | ||
|---|---|---|
| 食前投与b) | Cmax | 0.382[0.324, 0.450] |
| AUC0-τ | 0.863[0.797, 0.934] | |
| 食後投与c) | Cmax | 0.629[0.526, 0.752] |
| AUC0-τ | 0.870[0.788, 0.960] | |
a) IR錠0.2mg/日(1日2回投与)に対するXR錠0.4mg/日群(1日1回投与)の比:IR錠0.2mg/日投与時の1日用量と同等になるよう4倍に補正して算出した(IR錠は1mg/日まで線形性が確認されている)。
b) XR錠0.4mg/日群:n=20、IR錠0.2mg/日:n=20
c) XR錠0.4mg/日群:n=19、IR錠0.2mg/日:n=18
方法:TG高値の脂質異常症患者にXR錠0.4mg/日群を1日1回、又はIR錠0.2mg/日を1日2回に分けて食前又は食後に4週間反復経口投与した(2期クロスオーバー)。
排泄
(1)尿中及び糞中排泄率(外国人データ)6)
健康成人男性(7例)に14C-ペマフィブラート0.8mgを単回経口投与したとき、総放射能回収率(平均値)は投与量の87.81%であり、尿中へ14.53%、糞中へ73.29%の放射能が排泄された。尿中への排泄は投与24時間後までにほぼ終了したが、糞中への排泄は投与96時間後までにほぼ終了した。
尿中に認められたペマフィブラートは、投与放射能の0.47%以下であった。投与放射能の5%を超える成分が1種類認められ、ジカルボン酸体のグルクロン酸抱合体及びN-脱アルキル体の混合物と同定された。
糞中に認められたペマフィブラートは、投与放射能の1.69%以下であった。糞中代謝物の大部分(投与放射能の約50%)を占める成分は4-メトキシフェニル基脱メチル体と同定された。その他、投与放射能の5%を超える成分が2種類認められ、それぞれベンゾオキサゾール基(6位)水酸化体及びその4-メトキシフェニル基脱メチル体と同定された。
(2)呼気中排泄(ラット)7)
絶食の雌雄ラットに14C-ペマフィブラート1mg/kgを単回静脈内投与したとき、雌雄共に呼気中に放射能は検出されなかった。
(3)胆汁中排泄及び腸肝循環(ラット)7)
絶食の雄ラットに14C-ペマフィブラート1mg/kgを単回経口投与したとき、投与放射能の69.5%が、投与後48時間までに胆汁中に排泄された。
また、投与後8時間まで採取した胆汁を2g/kgの投与量で別個体の絶食の雄ラットに単回十二指腸内投与したとき、投与した胆汁中放射能の60.0%が、投与後48時間までに胆汁中に排泄された。
(4)トランスポーターを介した輸送(in vitro)7)
14C-ペマフィブラートは、in vitroにおいて、P-gp 、BCRP、OATP1A2、OATP1B1、OATP1B3、OCT2及びNTCPで輸送されることが示された。
【パルモディアXR錠(徐放性製剤)0.2mg・0.4mg】
通常、成人にはペマフィブラートとして1回0.2mgを1日1回経口投与する。ただし、トリグリセライド高値の程度により、1回0.4mgを1日1回まで増量できる。
薬物相互作用
(1)薬物代謝酵素及びトランスポーターに対する作用(in vitro)7)
ペマフィブラートはCYP2C9及びUGT1A1の代謝活性を阻害したが(IC50:17.7μmol/L及び5.91μmol/L)、臨床最大用量におけるヒト血漿中Cmax(0.00772μmol/L)に比べIC50は明らかに高値であった。CYP1A2、CYP2A6、CYP2B6、CYP2C8、CYP2C19、CYP2D6、CYP2E1、CYP3A4/5及びUGT2B7に対する阻害作用はほとんど認められなかった(IC50>30μmol/L)。CYP1A2、CYP2B6及びCYP3A4に対する誘導作用はほとんど示されなかった。
また、P-gp、BCRP、OATP1B1、OATP1B3、OAT1、OAT3及びMRP4を阻害したが(IC50:20.8、4.42、0.101、1.84、2.42、0.0961及び2~20μmol/L)、臨床最大用量におけるヒト血漿中Cmaxと比べると、各IC50は明らかに高値であった。また、理論消化管濃度(1.63μmol/L)と比べると、P-gp及びBCRPのIC50は高値であった。OCT2、MATE1、MATE2-K、OCT1、MRP2及びBSEPに対する阻害作用はほとんど認められなかった(OCT2:IC50>12.5μmol/L、その他:IC50>20μmol/L)。
(2)陰イオン交換樹脂の影響(in vitro)7)
ペマフィブラートの各種陰イオン交換樹脂(コレスチラミン、コレスチミド錠(日局)及びコレスチミド顆粒(日局))に対する吸着率を絶食時の人工腸液及び非絶食時の人工腸液中で評価した結果は次表のとおりであり、ペマフィブラートは食事の有無によらず陰イオン交換樹脂に吸着されやすいものと推察された。
ペマフィブラートの陰イオン交換樹脂への吸着率
| 陰イオン交換樹脂 | ペマフィブラート(0.8μg/mL)の 陰イオン交換樹脂への吸着率a)(%) |
||
|---|---|---|---|
| 名称 | 濃度 | 絶食時の人工腸液 | 非絶食時の人工腸液 |
| コレスチラミン | 16,000μg/mL | 100±0 | 97.0±0.1 |
| コレスチミド錠(日局) | 8,000μg/mL | 90.7±0.3 | 98.3±0.1 |
| コレスチミド顆粒(日局) | 8,000μg/mL | 90.8±0.1 | 98.0±0.2 |
平均値±標準偏差(n=3)
インキュベーション時間:120分
a) ペマフィブラートの陰イオン交換樹脂への吸着率(%)=(1-吸着陰イオン交換樹脂ありの場合のペマフィブラートの濃度/陰イオン交換樹脂なしの場合のペマフィブラートの平均濃度)×100
10.2 併用注意(併用に注意すること)
陰イオン交換樹脂(コレスチラミン、コレスチミド)
主要文献
5 ) 興和(株)社内資料:徐放性製剤の第Ⅱ相臨床薬理試験
6 ) 興和(株)社内資料:第Ⅰ相マスバランス試験(海外)(パルモディア錠0.1mg)
7 ) 興和(株)社内資料:非臨床試験 薬物動態試験(パルモディア錠0.1mg)
- パルモディア錠
(即放性製剤) - パルモディアXR錠
(徐放性製剤)

