有効性
- パルモディア錠
(即放性製剤) - パルモディアXR錠
(徐放性製剤)
パルモディア錠(即放性製剤)
第Ⅱ相用量探索的試験
安全性
| プラセボ群 | パルモディア錠(即放性製剤) | 微粉化フェノ フィブラート カプセル 100mg/日群 |
|||
|---|---|---|---|---|---|
| 0.05mg/日群 | 0.1mg/日群 | 0.2mg/日群 | 0.4mg/日群 | ||
| 8.3[1.8, 22.5] (3/36) |
5.4[0.7, 18.2] (2/37) |
2.7[0.1, 14.2] (1/37) |
5.3[0.6, 17.7] (2/38) |
5.1[0.6, 17.3] (2/39) |
10.8[3.0, 25.4] (4/37) |
発現割合(%)[95%信頼区間](発現例数/総症例数)
各群において認められた副作用は、プラセボ群で便秘2例5.6%、血中尿酸異常1例2.8%、パルモディア錠(即放性製剤)0.05mg/日群で肝障害、糖尿病(糖尿病の悪化)各1例2.7%、パルモディア錠(即放性製剤)0.1mg/日群で尿管結石1例2.7%、パルモディア錠(即放性製剤)0.2mg/日群で鼓腸、AST(GOT)増加、ALT(GPT)増加各1例2.6%、パルモディア錠(即放性製剤)0.4mg/日群で動悸、尿管結石各1例2.6%、微粉化フェノフィブラートカプセル100mg/日群で肝機能異常、血中ミラーゼ増加、ヘマトクリット減少、尿中血陽性、ヘモグロビン減少各1例2.7%であった。
重篤な副作用はパルモディア錠(即放性製剤)0.4mg/日群で尿管結石1例が認められた。副作用により投与中止に至った症例は1例あり、微粉化フェノフィブラートカプセル100mg/日群の肝機能異常であった。
【パルモディア錠(即放性製剤)】
6. 用法及び用量
通常、成人にはペマフィブラートとして1回0.1mgを1日2回朝夕に経口投与する。なお、年齢、症状に応じて適宜増減するが、最大用量は1回0.2mgを1日2回までとする。
微粉化フェノフィブラートカプセル【用法及び用量】
通常、成人にはフェノフィブラートとして1日1回134mg〜201mgを食後経口投与する。
なお、年齢、症状により適宜減量する。1日201mgを超える用量は投与しないこと。
[用法及び用量に関連する使用上の注意(抜粋)]
1. 総コレステロール及びトリグリセライドの両方が高い高脂血症(IIb及びIII型)には、1日投与量を134mgより開始すること。なお、これらの高脂血症患者において、高血圧、喫煙等の虚血性心疾患のリスクファクターを有し、より高い治療目標値を設定する必要のある場合には1日投与量を200mg~201mgとすること。
2. トリグリセライドのみが高い高脂血症(IV及びV型)には、1日投与量67mgにおいても低下効果が認められているので、1日投与量を67mgより開始すること。
-
試験デザイン
多施設共同、プラセボ/実薬対照、無作為化、二重盲検、並行群間比較試験
-
対 象
脂質異常症患者[200mg/dL≤空腹時血清TG≤500mg/dL、HDL-C<50mg/dL(男性)、55mg/dL(女性)]
-
方 法
プラセボ、パルモディア錠(即放性製剤)0.05mg/日、0.1mg/日、0.2mg/日又は0.4mg/日を1日2回に分けて朝夕食後、微粉化フェノフィブラートカプセル100mg/日(錠剤80mg/日に相当)を1日1回朝食後に12週間経口投与した。
-
評価項目
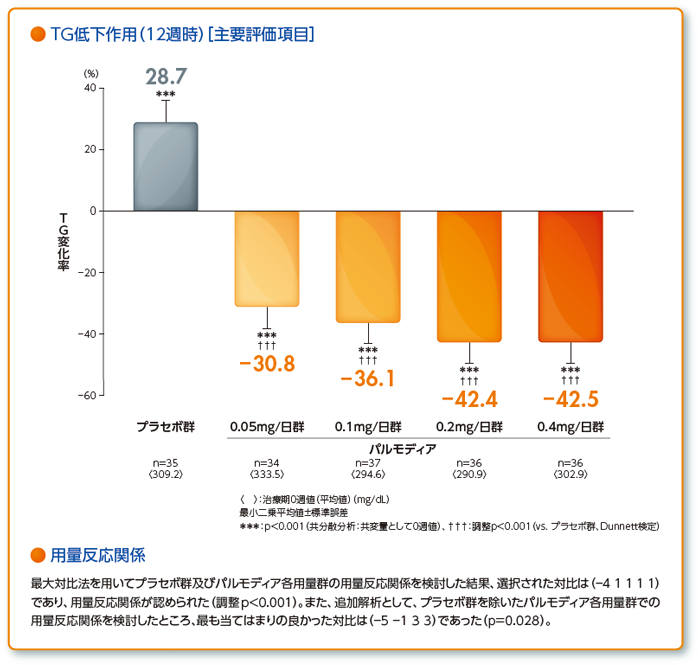
- [有効性]主要評価項目:
- 治療期終了時(12週時)の空腹時血清TGの治療期0週からの変化率
- 副次的評価項目:
-
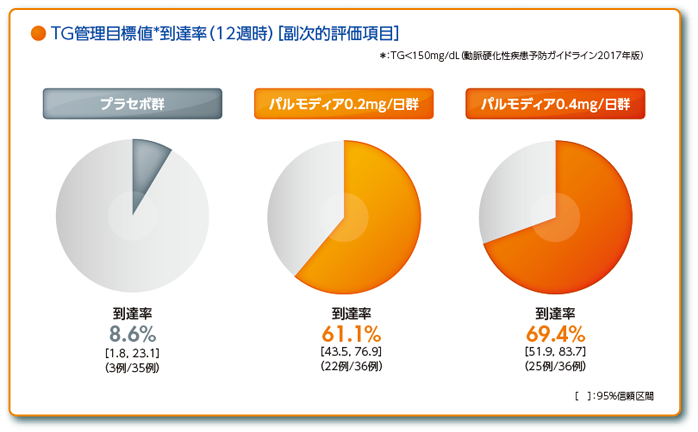
・空腹時血清TG150mg/dL未満への到達率(プラセボ群、パルモディア錠(即放性製剤)0.2mg/日群、0.4mg/日群の成績を記載)
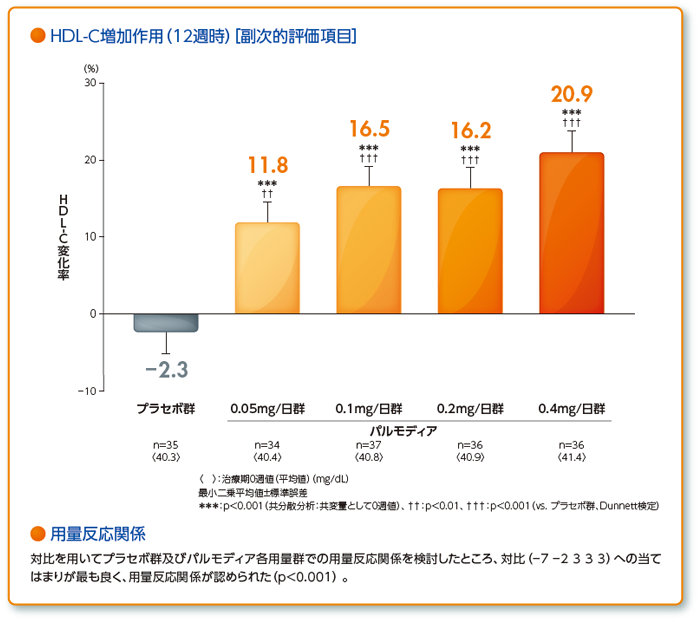
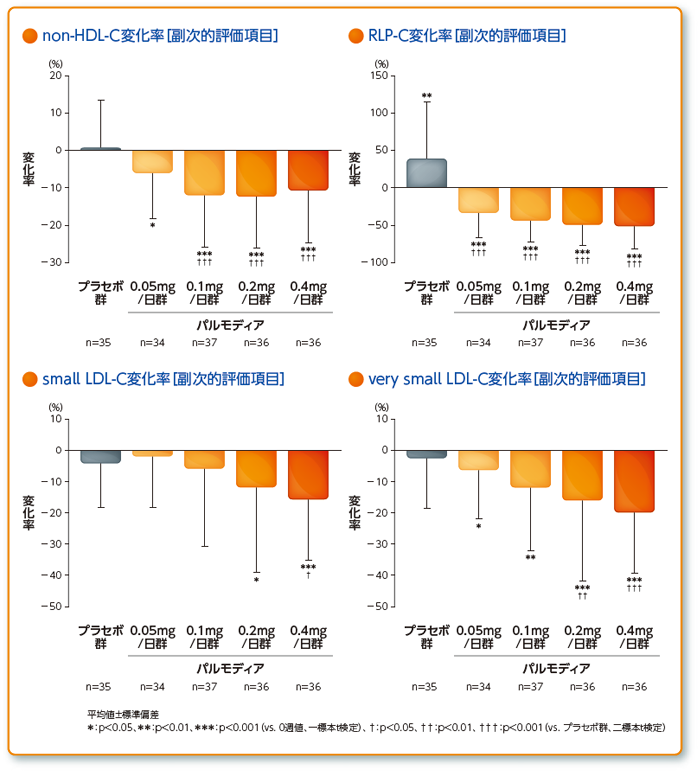
・空腹時血清HDL-C、non-HDL-C、RLP-C、small LDL-C、very small LDL-Cの治療期0週からの変化率 他
- [安全性]主要評価項目:
- 副作用発現割合 他
-
解析計画
- [主解析]
- 空腹時血清TG変化率について、用量反応関係を検討する。用量反応関係が認められた場合は副次的解析を行う。
- [副次的解析]
- 本剤各用量群のプラセボ群に対する優越性を検討する。
- [探索的解析]
- 本剤各用量群と微粉化フェノフィブラートカプセル100mg/日群の有効性を比較する。
興和(株)社内資料:第Ⅱ相用量探索的試験(承認時評価資料)
第Ⅲ相TG高値を示す脂質異常症患者を対象とした長期投与試験
安全性
副作用発現割合は次表のとおりであった。
| 0.2mg/日(0.4mg/日に増量29例を含む)群 | 31.7[25.2, 38.9](60/189) |
|---|
発現割合(%)[95%信頼区間](発現例数/総症例数)
パルモディア錠(即放性製剤)投与例全体で3.0%以上に認められた副作用は胆石症10例5.3%であった。
重篤な副作用は脳梗塞1例が認められた。副作用により投与中止に至った症例は7例であり、その内訳は胆石症2例、AST(GOT)増加/ALT(GPT)増加、慢性腎臓病(慢性腎不全の悪化)、薬疹、低比重リポ蛋白(LDL-C)増加/胆石症、糖尿病(糖尿病の悪化)各1例であった。
-
試験デザイン
多施設共同、非盲検試験
-
対 象
脂質異常症患者(150mg/dL≤空腹時血清TG<500mg/dL)
-
方 法
パルモディア錠(即放性製剤)0.2mg/日(効果不十分注)の場合、12週以降に0.4mg/日に適宜増量可)を1日2回に分けて朝夕食前又は食後に52週間経口投与した。
注):空腹時血清TGが150mg/dL以上の場合を目安とした。 -
評価項目
- [有効性]主要評価項目:
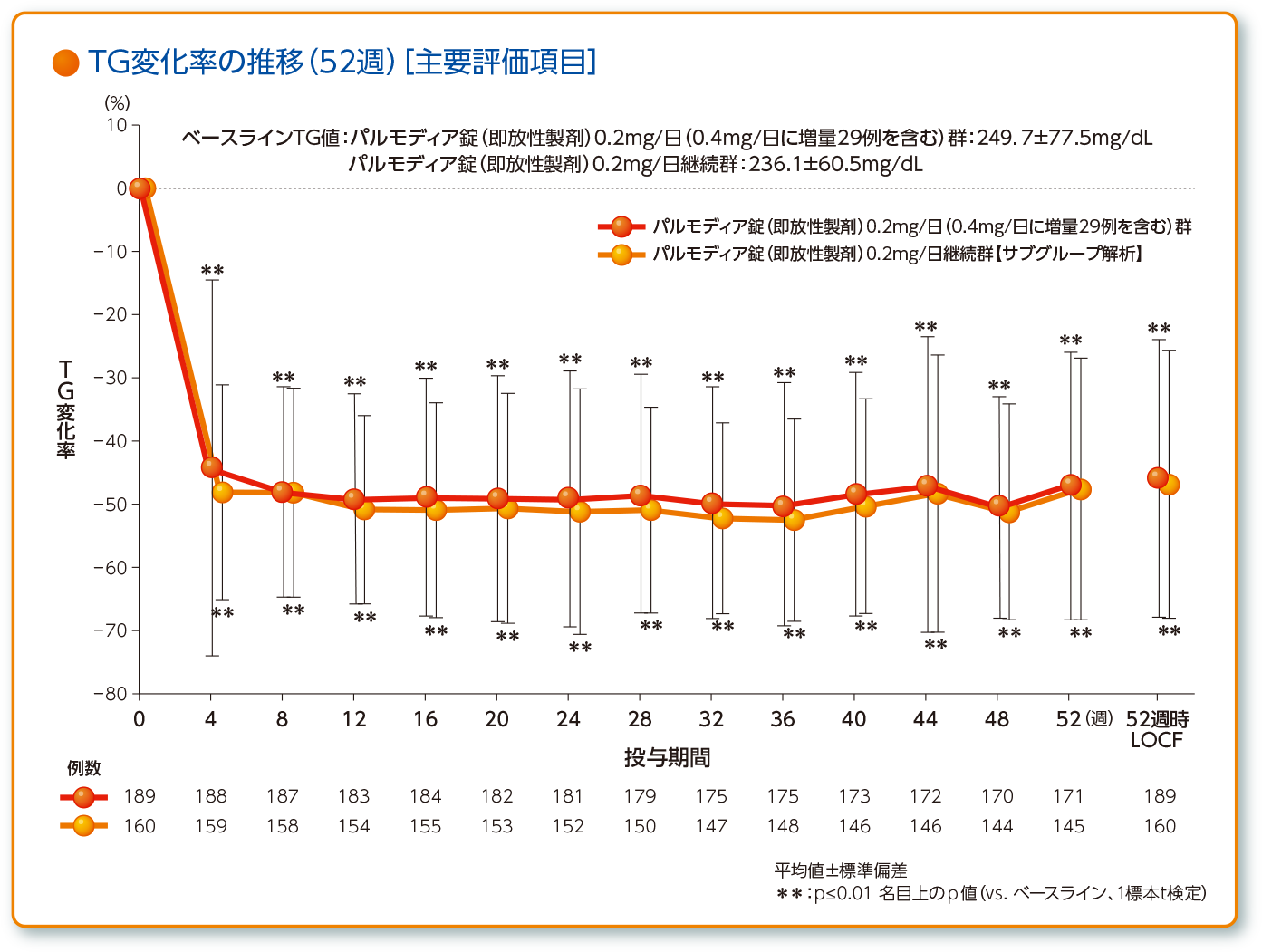
- 最終評価時LOCF(治療期52週又は中止時)における空腹時血清TGのベースラインからの変化率
- [安全性]主要評価項目:
- 副作用発現割合 他
-
解析計画
主解析として全例を評価し、サブグループ解析としてパルモディア錠(即放性製剤)0.2mg/日継続群の部分集団を検討した。
興和(株)社内資料:第Ⅲ相TG高値を示す脂質異常症患者を対象とした52週長期投与試験(承認時評価資料)
第Ⅲ相2型糖尿病を合併した脂質異常症患者を対象とした長期投与試験
安全性
副作用発現割合は次表のとおりであった。
| プラセボ→0.2mg/日群a) | パルモディア錠(即放性製剤) | |
|---|---|---|
| 0.2mg/日群 | 0.4mg/日群 | |
| 21.8[11.8, 35.0](12/55) | 20.4[10.6, 33.5](11/54) | 27.3[16.1, 41.0](15/55) |
発現割合(%)[95%信頼区間](発現例数/総症例数)
a) 治療期 24 週時までに発現した事象を除く
各群において3.0%以上に認められた副作用は、プラセボ→パルモディア錠(即放性製剤)0.2mg/日群で糖尿病(糖尿病の悪化)2例3.6%、パルモディア錠(即放性製剤)0.2mg/日群で胆石症、糖尿病(糖尿病の悪化)各2例3.7%、パルモディア錠(即放性製剤)0.4mg/日群で胆石症、糖尿病(糖尿病の悪化)各3例5.5%、血中ミオグロビン増加、高ホモシステイン血症各2例3.6%であった。
本試験において重篤な副作用はパルモディア錠(即放性製剤)0.2mg/日群で胆管結石1例が認められた。副作用により投与中止に至った症例は4例であり、その内訳は重篤な副作用の1例のほか、パルモディア錠(即放性製剤)0.4mg/日群で急性腎不全、肝機能異常各1例、プラセボ→パルモディア錠(即放性製剤)0.2mg/日群(治療期第2期)で湿疹1例であった。
11. 副作用(抜粋)
11.2 その他の副作用
糖尿病(悪化を含む)
-
試験デザイン
多施設共同、プラセボ対照、無作為化、二重盲検、並行群間比較試験
-
対 象
2型糖尿病を合併した脂質異常症患者(150mg/dL≤空腹時血清TG≤1000mg/dL、6.2%≤HbA1c(NGSP値)<8.0%)
-
方 法
プラセボ→パルモディア錠(即放性製剤)0.2mg/日(24週時よりプラセボからパルモディア0.2mg/日に切り替え)、パルモディア錠(即放性製剤)0.2mg/日又は0.4mg/日を1日2回に分けて朝夕食前又は食後に52週間経口投与した。また、同意が得られた患者を対象として、治療期24週時及び52週時に食後のTG、RLP-C等を経時的に測定した。食事は、ミールテストC(脂質28.5g、糖質75.0g)で統一した。
-
評価項目
- [有効性]主要評価項目:
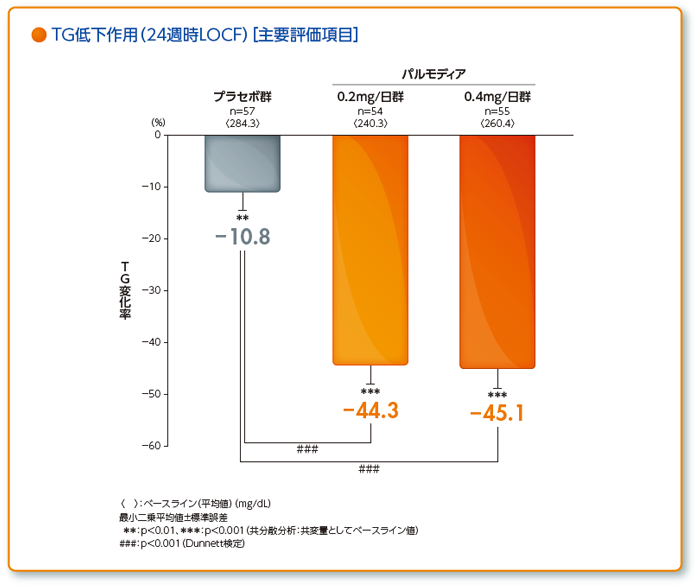
- 治療期第1期の最終評価時LOCF(24週時又は中止時)における空腹時血清TGのベースラインからの変化率
- 副次的評価項目:
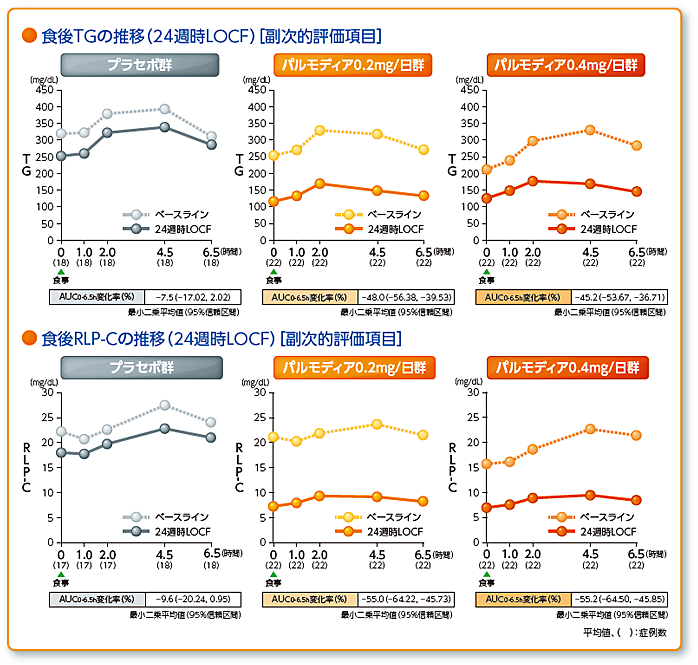
- 食後TG、RLP-CのAUC0-6.5hのベースラインからの変化率 他
- [安全性]主要評価項目:
- 副作用発現割合 他
興和(株)社内資料:第相2型糖尿病を合併した脂質異常症患者を対象とした長期投与試験(承認時評価資料)
第Ⅲ相HMG-CoA還元酵素阻害薬で治療中の患者を対象とした長期投与試験
安全性
副作用発現割合は次表のとおりであった。
| プラセボ群 | パルモディア錠(即放性製剤) | |
|---|---|---|
| 0.2mg/日群 | 0.2(0.4)mg/日群 | |
| 15.7[9.4, 24.0](17/108) | 19.3[13.3, 26.6](29/150) | 19.4[13.7, 26.3](32/165) |
発現割合(%)[95%信頼区間](発現例数/総症例数)
各群において2例以上に認められた副作用は、プラセボ群で便秘、発疹各2例1.9%、パルモディア錠(即放性製剤)0.2mg/日群で胆石症、糖尿病(糖尿病の悪化)各3例2.0%、浮動性めまい、湿疹、高血圧各2例1.3%、パルモディア錠(即放性製剤)0.2(0.4)mg/日群で糖尿病(糖尿病の悪化)8例4.8%、血清フェリチン増加3例1.8%、血中CK(CPK)増加、血中甲状腺刺激ホルモン増加各2例1.2%であった。
重篤な副作用はプラセボ群で塞栓性脳卒中1例、パルモディア錠(即放性製剤)0.2mg/日群で腹壁血腫1例、0.2(0.4)mg/日群で糖尿病(糖尿病の悪化)1例が認められた。副作用により投与中止に至った症例は14例であり、その内訳は重篤な副作用の3例のほか、プラセボ群で発疹が1例、パルモディア錠(即放性製剤)0.2mg/日群で浮動性めまい、倦怠感、胆石症、湿疹各1例、0.2(0.4)mg/日群で発疹、じん麻疹(じん麻疹の悪化)、倦怠感、血中CK(CPK)増加/血中ミオグロビン増加、慢性気管支炎、血中フィブリノゲン減少各1例であった。
9. 特定の背景を有する患者に関する注意(抜粋)
9.2 腎機能障害患者
9.2.2 腎機能に関する臨床検査値に異常が認められる患者
本剤とHMG-CoA還元酵素阻害薬を併用する場合には、治療上やむを得ないと判断される場合にのみ併用すること。急激な腎機能悪化を伴う横紋筋融解症があらわれやすい。やむを得ず併用する場合には、本剤を少量から投与開始するとともに、定期的に腎機能検査等を実施し、自覚症状(筋肉痛、脱力感)の発現、CK上昇、血中及び尿中ミオグロビン上昇並びに血清クレアチニン上昇等の腎機能の悪化を認めた場合は直ちに投与を中止すること。[7. 、10.2 、11.1.1参照]
10. 相互作用(抜粋)
10.2 併用注意(併用に注意すること)
HMG-CoA還元酵素阻害薬(プラバスタチンナトリウム、シンバスタチン、フルバスタチンナトリウム等)[9.2.2、11.1.1参照]
-
試験デザイン
多施設共同、プラセボ対照、無作為化、二重盲検、並行群間比較試験
-
対 象
HMG-CoA還元酵素阻害薬で治療中の脂質異常症患者(200mg/dL≤空腹時血清TG≤1000mg/dL)。ただし、腎機能障害のある者(血清クレアチニン1.5mg/dL以上)を除外。
-
方 法
プラセボ、パルモディア錠(即放性製剤)0.2mg/日又は0.2(0.4)mg/日(8週時の空腹時血清TG値≥150mg/dLの場合、12週時よりパルモディア錠(即放性製剤)0.2mg/日から0.4mg/日に増量)を1日2回に分けて朝夕食前又は食後に24週間経口投与した。
-
評価項目
- [有効性]主要評価項目:
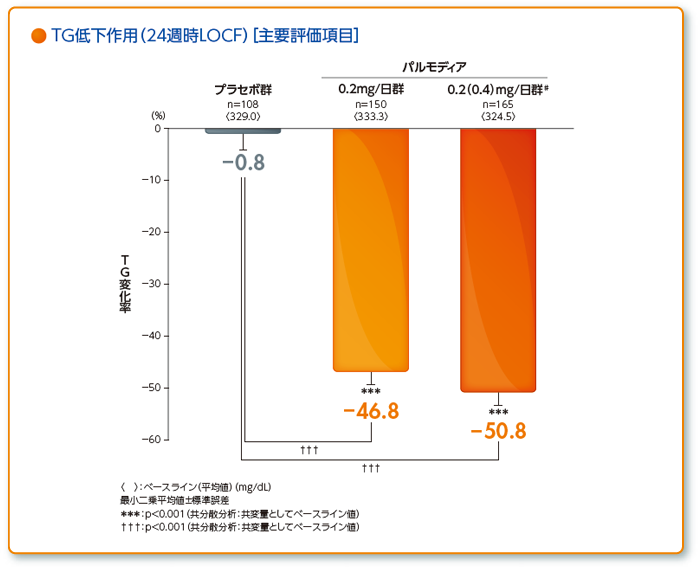
- 治療期終了時LOCF(治療期24週時又は中止時)の空腹時血清TGのベースラインからの変化率
- 副次的評価項目:
- 空腹時血清HDL-Cのベースラインからの変化率 他
- [安全性]主要評価項目:
- 副作用発現割合 他
興和(株)社内資料:第Ⅲ相HMG-CoA還元酵素阻害薬で治療中の患者を対象とした長期投与試験(承認時評価資料)
パルモディアXR錠(徐放性製剤)
第Ⅲ相検証試験

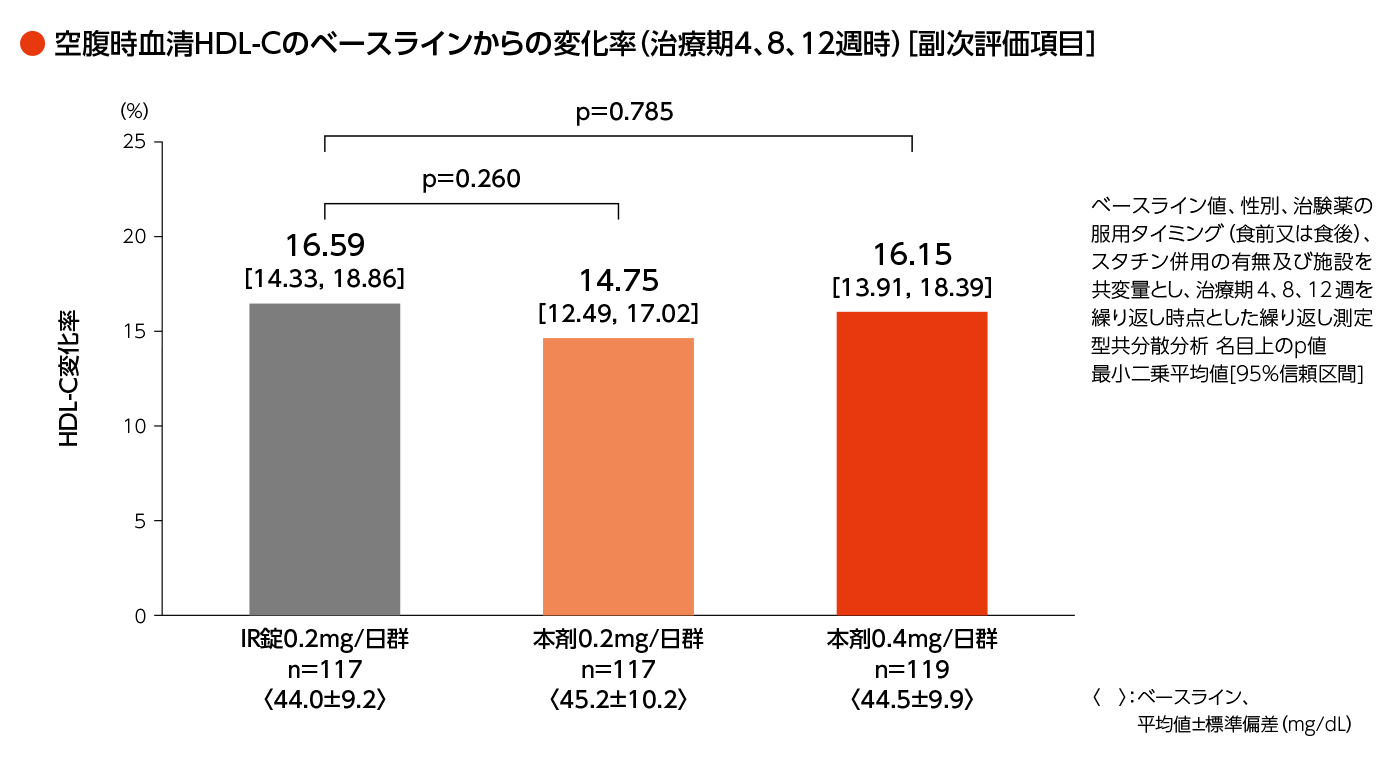
安全性
副作用発現割合はパルモディア錠(即放性製剤)0.2mg/日群、パルモディアXR錠0.2mg/日群、パルモディアXR錠0.4mg/日群でそれぞれ5.9%(7/118例)、2.5%(3/118例)、5.9%(7/119例)でした。
各群において2例以上に認められた副作用は、パルモディア錠(即放性製剤)0.2mg/日群で血中ケトン体増加2例1.7% 、パルモディアXR錠0.2mg/日群でALT増加2例1.7% 、パルモディアXR錠0.4mg/日群で血中ケトン体増加2例1.7%でした。
本試験において重篤な副作用は認められませんでした。投与中止に至った副作用は、パルモディア錠(即放性製剤)0.2mg/日群で浮動性めまい、筋肉痛が各1例でした。
-
試験デザイン
多施設共同、無作為化、二重盲検、実薬対照、並行群間比較試験
-
対 象
空腹時血清TG高値(200mg/dL以上1000mg/dL以下)を示す脂質異常症患者
-
方 法
パルモディアXR錠0.2mg/日又はパルモディアXR錠0.4mg/日を1日1回、パルモディア錠(即放性製剤)0.2mg/日を1日2回に分けて食前又は食後に12週間経口投与した。
-
評価項目
- [有効性]主要評価項目:
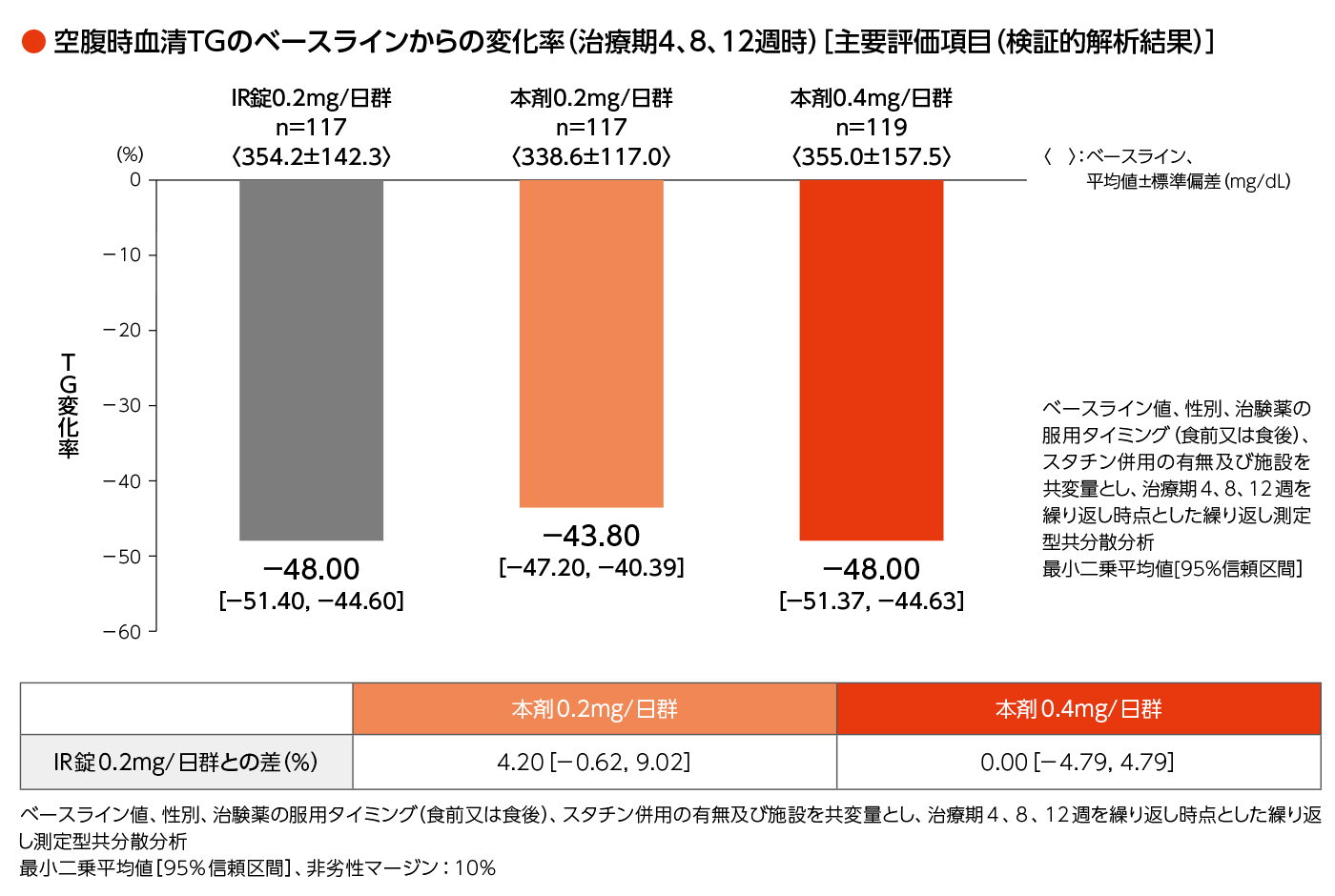
- 治療期4、8、12週時の空腹時血清TGのベースラインからの変化率(検証的な解析事項)
- 副次的評価項目:
-
・治療期12週時における空腹時血清TG<150mg/dLへの到達率
・治療期4、8、12週時における空腹時採血のHDL-C、LDL-C、non-HDL-C*のベースラインからの変化率ほか
*:non-HDL-C=TC-HDL-Cで算出 - [安全性]
- 副作用の有無ほか
-
解析計画
- [主解析]
-
FASを対象に解析を行った。
ベースライン値、性別、治験薬の服用タイミング(食前又は食後)、スタチン併用の有無及び施設を共変量とし、治療期4、8、12週を繰り返し時点とした繰り返し測定型共分散分析を行い、パルモディアXR錠0.2mg/日群及びパルモディアXR錠0.4mg/日群のパルモディア錠(即放性製剤)0.2mg/日群に対する非劣性、及び、パルモディアXR錠0.4mg/日群のパルモディアXR錠0.2mg/日群に対する点推定値の比較を以下の固定順序法に従って実施した。なお、非劣性マージンは10%とした。手順1:パルモディアXR錠0.4mg/日(1日1回)群のパルモディア錠(即放性製剤)0.2mg/日(1日2回)群に対する非劣性の検討を行う。非劣性が主張できた場合は手順2に進むこととした。
手順2:パルモディアXR錠0.2mg/日(1日1回)群のパルモディア錠(即放性製剤)0.2mg/日(1日2回)群に対する非劣性の検討を行う。非劣性が主張できた場合は手順3に進むこととした。
手順3:パルモディアXR錠0.4mg/日(1日1回)群の点推定値がパルモディアXR錠0.2mg/日(1日1回)群のそれよりも下回っていることを確認する。
興和(株)社内資料:徐放性製剤の第Ⅲ相検証試験(承認時評価資料)
第Ⅲ相長期投与試験
安全性
副作用発現割合は、全例で19.0%(23/121例)、朝投与群、夕投与群でそれぞれ18.0%(11/61例)、20.0%(12/60例)でした。
パルモディアXR錠投与全例で2 例以上に認められた副作用は筋肉痛3 例(夕投与群3 例5.0%)、筋痙縮2 例(朝投与群1 例1.6%、夕投与群1 例1.7%)、関節周囲炎2 例(朝投与群1 例1.6%、夕投与群1 例1.7%)、血中クレアチンホスホキナーゼ増加2例(朝投与群1例1.6%、夕投与群1例1.7%)、発疹2例(朝投与群1例1.6%、夕投与群1例1.7%)、高血圧2例(朝投与群1 例1.6%、夕投与群1 例1.7%)でした。重篤な副作用は不整脈1例(朝投与群)であり、投与中止に至った。その他投与中止に至った副作用は、4例であり、その内訳は筋肉痛、無力症/筋肉痛/異常感、湿疹、血中クレアチンホスホキナーゼ増加各1例(いずれも夕投与群)でした。
-
試験デザイン
多施設共同、無作為化、非盲検、並行群間比較試験
-
対 象
空腹時血清TG高値(150mg/dL以上1000mg/dL以下)を示す脂質異常症患者
-
方 法
パルモディアXR錠0.2mg/日(効果不十分な場合は、治療期12週以降0.4mg/日に増量)を1日1回朝又は夕に52週間経口投与した。
-
評価項目
- [有効性]主要評価項目:
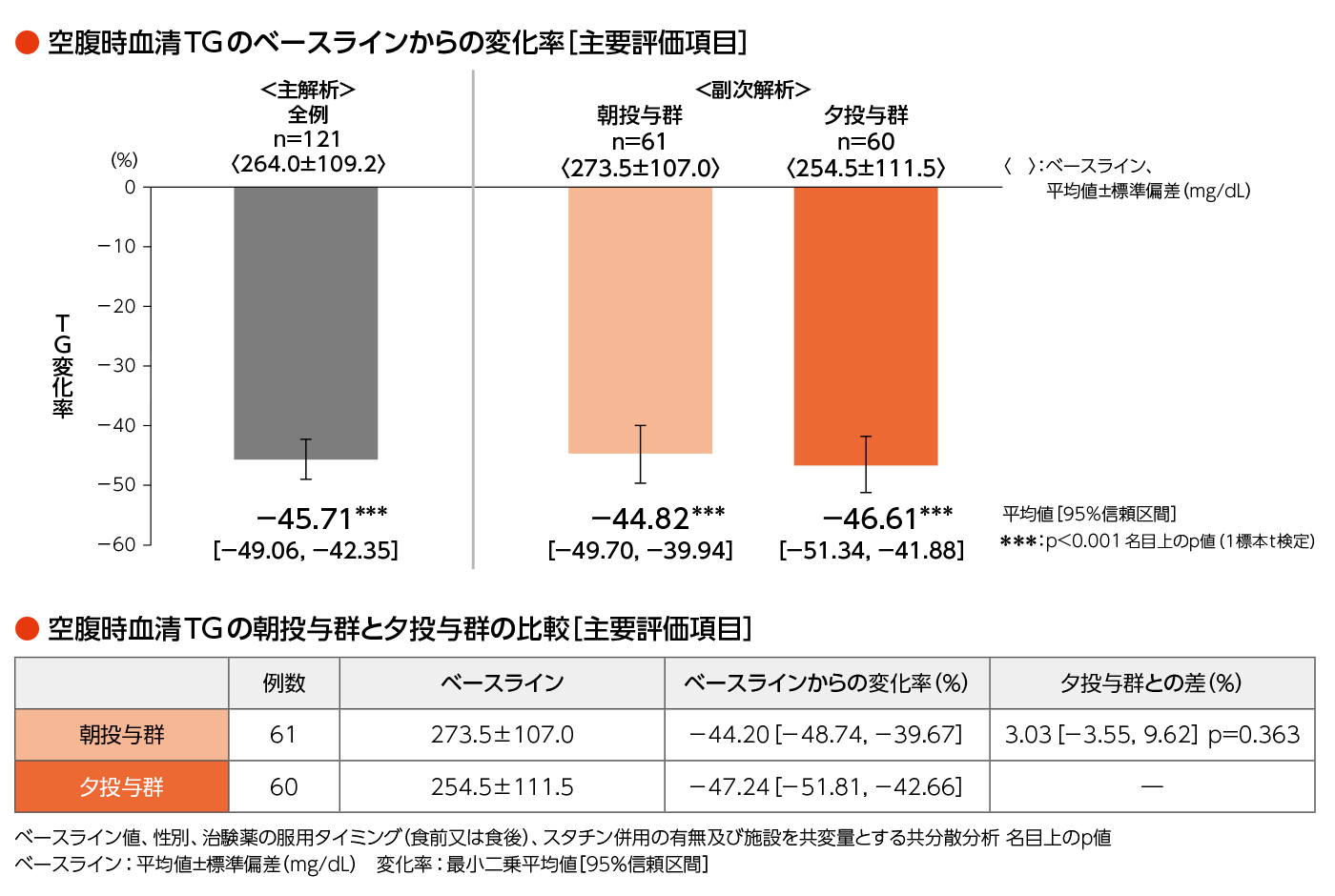
- 最終評価時*及びその直前の時点における空腹時血清TGのベースラインからの変化率の平均値
*:治療期52週又は中止時、以降同様 - 副次的評価項目:
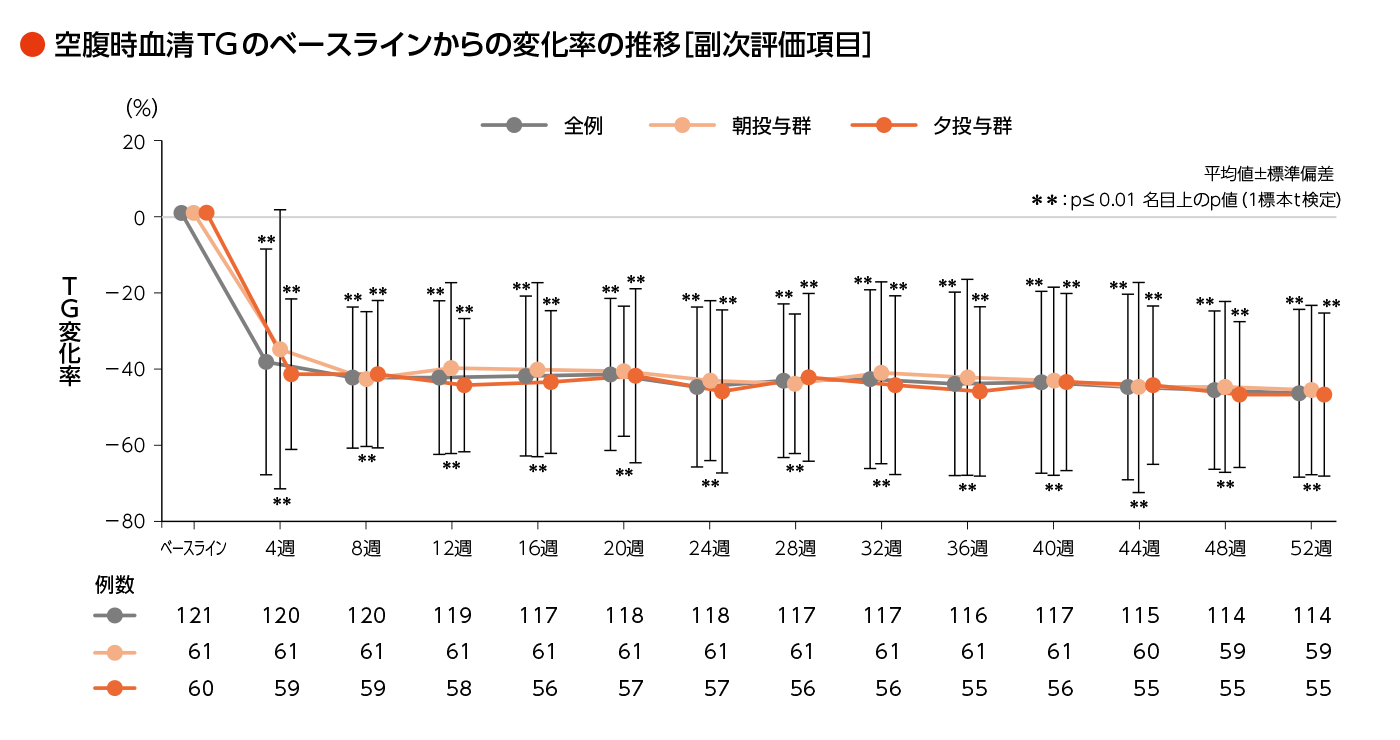
- 各時点における空腹時血清TGのベースラインからの変化率ほか
- [安全性]
- 副作用の有無ほか
-
解析計画
- [主解析]
- 各被験者の最終評価時とその直前におけるTGのベースラインからの変化率の平均値を求め、全例における基本統計量の算出と1標本t検定を実施した。
- [副次的解析]
- 投与群のそれぞれで、主解析と同様の解析を行った。また、ベースライン値、性別、治験薬の服用タイミング(食前又は食後)、スタチン併用の有無及び施設を共変量とする共分散分析を行い、投与群間の比較を行った。
興和(株)社内資料:徐放性製剤の第Ⅲ相長期投与試験(承認時評価資料)
- パルモディア錠
(即放性製剤) - パルモディアXR錠
(徐放性製剤)

